
東北大学・大学院生命科学研究科/超回路脳機能分野
兼・東北大学・大学院医学系研究科/超回路脳機能分野
研究内容
我々の身体を構成する無数の細胞は、バラバラにならずに連携し合うことで、ひとつの個体としての整合性を保っています。脳の中には、神経細胞やグリア細胞があり、それぞれの形成する回路の活動は、電気生理学や Ca2+イメージング法で観察できます。また、この二つの回路の間を、信号が行き交うことも示唆されてきました。我々はこれまで、神経から神経、神経からグリア、グリアから神経の間で、どのようにして、信号の受け渡しが行われているのかを調べてきました。信号の受け渡し過程を調べることで、脳回路の動作原理が明らかになり、我々の心の機能がいかに成立しているのかを理解することにつながると考えているからです。
当研究室では、脳細胞間の信号伝達を解析するのに、主に、急性脳スライス標本からのパッチクランプ法を使っています。具体的には、マウスやラットなどの脳を素早く取り出して、生きたままの脳組織を 200 ミクロン程度の薄いスライス切片にし、これを顕微鏡下で観察しながら、ガラス管電極を使って、個々の細胞の電気的な活動を記録しています。また、Ca2+蛍光色素などを細胞に取り込ませることにより、細胞内イオン環境の変動を二光子イメージング法で記録することも行っています。さらに、最近は、光に反応する分子を特定の細胞種に発現させて、その細胞種の活動だけを光で興奮させたり、抑制させたりする技術、オプトジェネティクス(光遺伝学)も取り込んでいます。
脳細胞の活動を光や電気を使って操作して、その結果生じる応答を、光や電気を使って計測する。このようにして、各細胞間の相互作用が、脳という回路の中でどんな役割を持っているのか、どんな機能を果たしているのかを調べています。個々の細胞間の相互作用が、「心」が生まれる背景にあり、最終的には個体としての行動を支配することになると考えています。そこで、生きたままの動物の脳内に光ファイバーを差し込んで、特定の細胞種の活動を光操作することによって、どのような脳機能の変化、行動の変化が見られるのかも解析しています。
神経から神経へ
細胞同士の信号伝達の多くは、伝達物質が媒介します。神経から神経への信号伝達は、シナプスという局所で行われ、シナプス前細胞が興奮すると伝達物質が放出され、これがシナプス後細胞の受容体を活性化して信号が伝わります。これまで、伝達物質がどのくらいの濃度になるのか、また、どのくらいの速さで拡散するのかを明らかにすることに取り組んでまいりました。ミクロの空間での伝達物質の振る舞いによって、シナプス伝達特性が大きく影響を受けるからです。
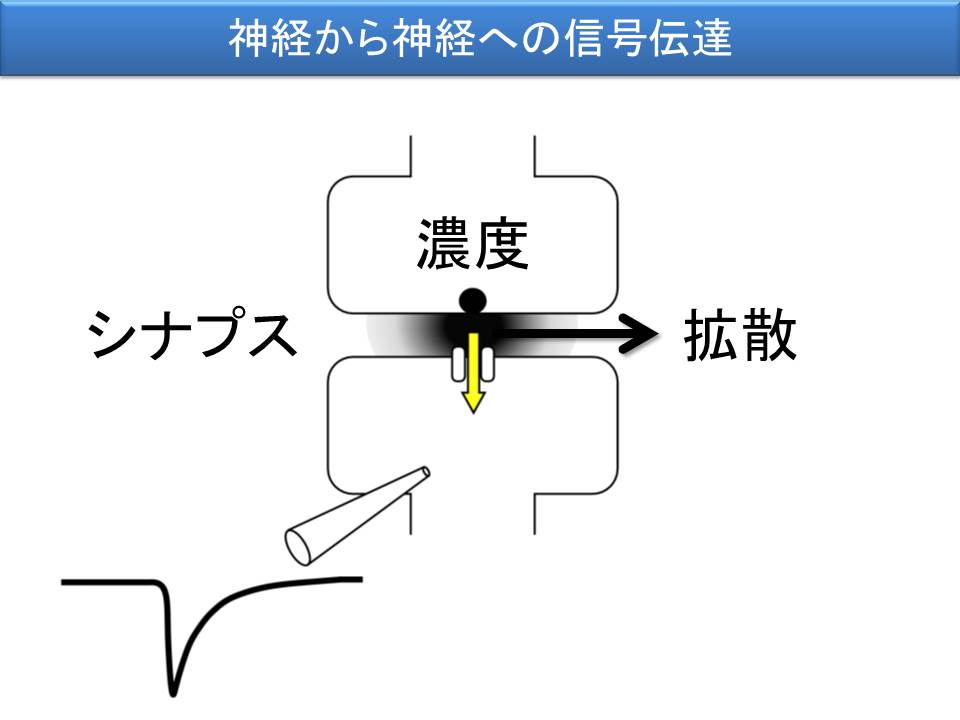
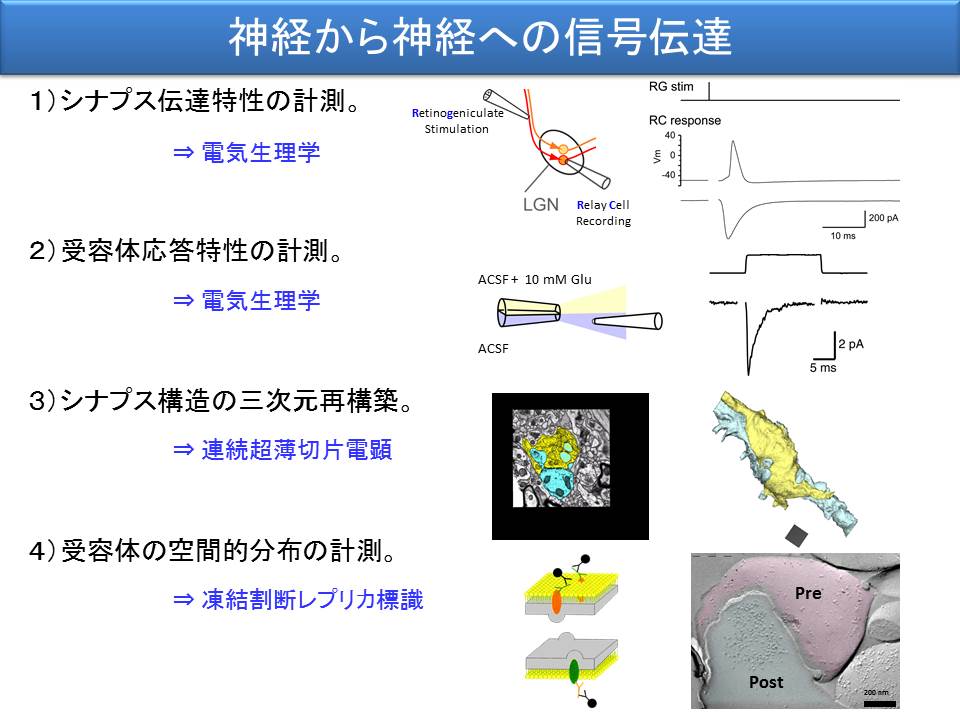
ここでも学際的アプローチを採っています。神経線維を刺激して、入力を受け取る神経細胞からのシナプス応答を解析するのには、電気生理学的手法を用い、伝達物質に対して反応する受容体の応答特性を計測するには、受容体を発現した膜を切り剥がしてくるパッチ膜記録を使い、シナプスというミクロの空間構造は、連続超薄切片の電子顕微鏡観察で調べ、このミクロの構造の中で、どこに受容体が分布するのかを調べるのに、凍結割断レプリカ標識法を用いています(重本隆一先生(現、IST Austria・教授)、深澤有吾先生(現、名古屋大学・分子細胞学分野・准教授)、釜澤尚美先生(現、Max Planck Florida Institute・EM Manger)との共同研究)。
動画が再生できない場合はFirefox等をお試しください。
動画が再生できない場合はFirefox等をお試しください。
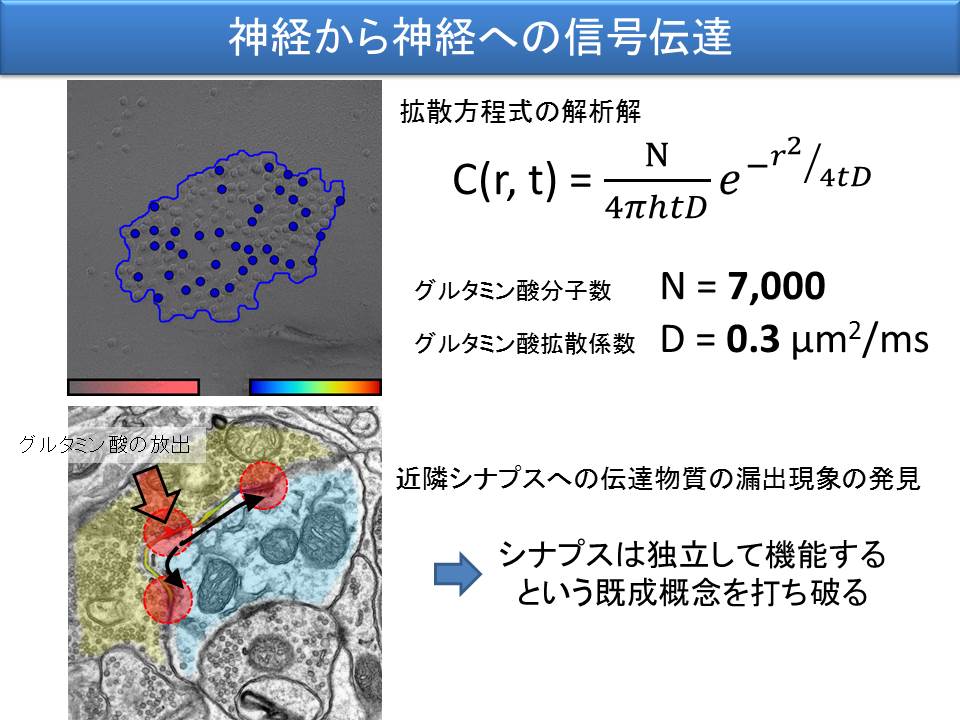
数理的シミュレーションを用いることで、興奮性シナプスでは、およそ 7000 個のグルタミン酸分子が 0.3 µm2/ms という速度で拡散することが明らかになりました。さらに実験を重ねた結果、放出された伝達物質が、シナプスの境界を越えることも分かりました。これは、個々のシナプスは独立して機能するという既成概念を打ち破るものです。どの細胞とどの細胞がつながっているのかを調べさえすれば、神経回路の振る舞いを全て理解できるはずだとする風潮がありますが、そうではないのです。シナプスを取り囲むミクロン・ナノ単位の空間を再構成し、受容体分子の配置を明らかにしなければ、たった二つの神経細胞間での信号の受け渡し過程すら理解したことにならないことが示されました。
動画が再生できない場合はFirefox等をお試しください。
動画が再生できない場合はFirefox等をお試しください。
参考文献
-
Budisantoso T, Harada H, Kamasawa N, Fukazawa Y, Shigemoto R, Matsui K* (2013) Evaluation of glutamate concentration transient in the synaptic cleft of the rat calyx of Held.
Journal of Physiology, 591: 219–239.
(* corresponding author )
-
松井 広 (2013) 視床:単なる中継核ではない‐生理学的基礎. Clinical Neuroscience, 31: 24–26.
-
Budisantoso T†, Matsui K†*, Kamasawa N, Fukazawa Y, Shigemoto R (2012) Mechanisms underlying signal filtering at a multi-synapse contact.
Journal of Neuroscience, 32: 2357–2376.
(† equal contribution, * corresponding author )
-
深澤有吾, 足澤悦子, 松井 広, 重本隆一 (2008) グルタミン酸受容体のシナプス内分布とその生理的意義. 蛋白質核酸酵素, 53: 435–441.
-
Tarusawa E, Matsui K*, Budisantoso T, Molnár E, Watanabe M, Matsui M, Fukazawa Y*, Shigemoto R (2009) Input-specific intrasynaptic arrangements of ionotropic glutamate receptors and their impact on postsynaptic responses.
Journal of Neuroscience, 29: 12896–12908.
(* corresponding authors ) (Reviewed in "Faculty of 1000" )
-
Matsui K, Hasegawa J, Tachibana M (2001) Modulation of excitatory synaptic transmission by GABAC receptor-mediated feedback in the mouse inner retina.
Journal of Neurophysiology, 86: 2285–2298.
-
Matsui K, Hosoi N, Tachibana M (1999) Active role of glutamate uptake in the synaptic transmission from retinal nonspiking neurons.
Journal of Neuroscience, 19: 6755–6766.
-
Matsui K, Hosoi N, Tachibana M (1998) Excitatory synaptic transmission in the inner retina: paired recordings of bipolar cells and neurons of the ganglion cell layer.
Journal of Neuroscience, 18: 4500–4510.
神経からグリアへ
脳の中には、神経よりはるかに数の多いグリアという細胞があります。我々の心は神経回路の活動によって形作られていると考えがちですが、活発なグリア回路の活動を見てしまうと、これにはいったいどんな意味があるのだろうと考えざるを得ません。しかし、我々の筋肉は神経の支配下にあるので、神経回路とグリア回路の間に、何らかの相互作用がなければ、グリア回路が我々の心や行動に役割あるとは言えません。これまで行ってきた、神経間のシナプス伝達を調べるのと同様のストラテジーで、神経からグリアへの信号伝達が研究できるのではないかと考えております。
動画が再生できない場合はFirefox等をお試しください。
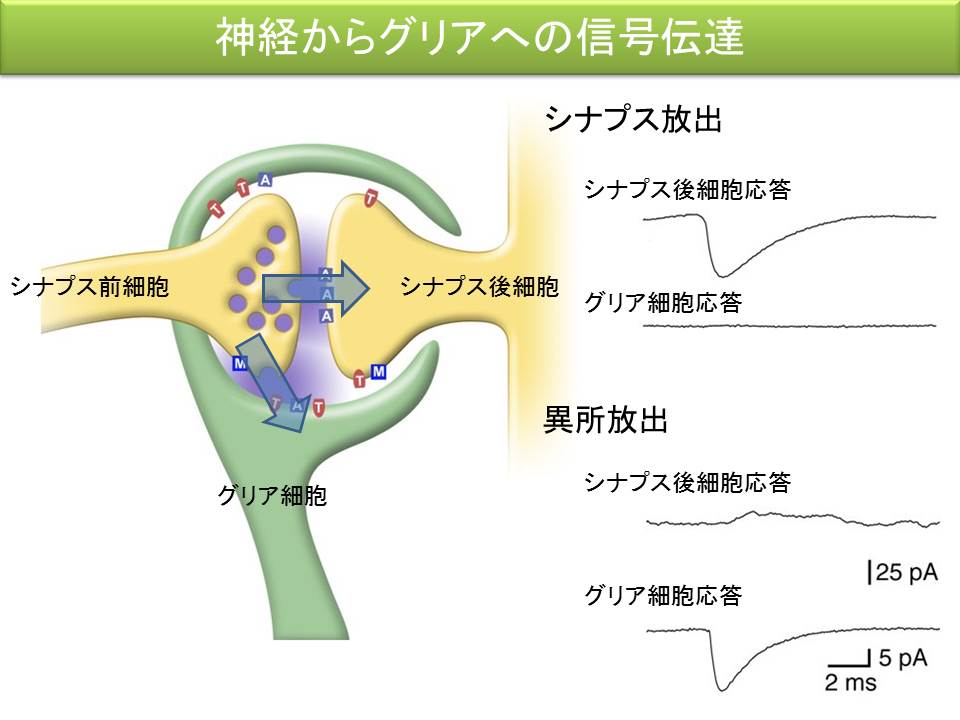
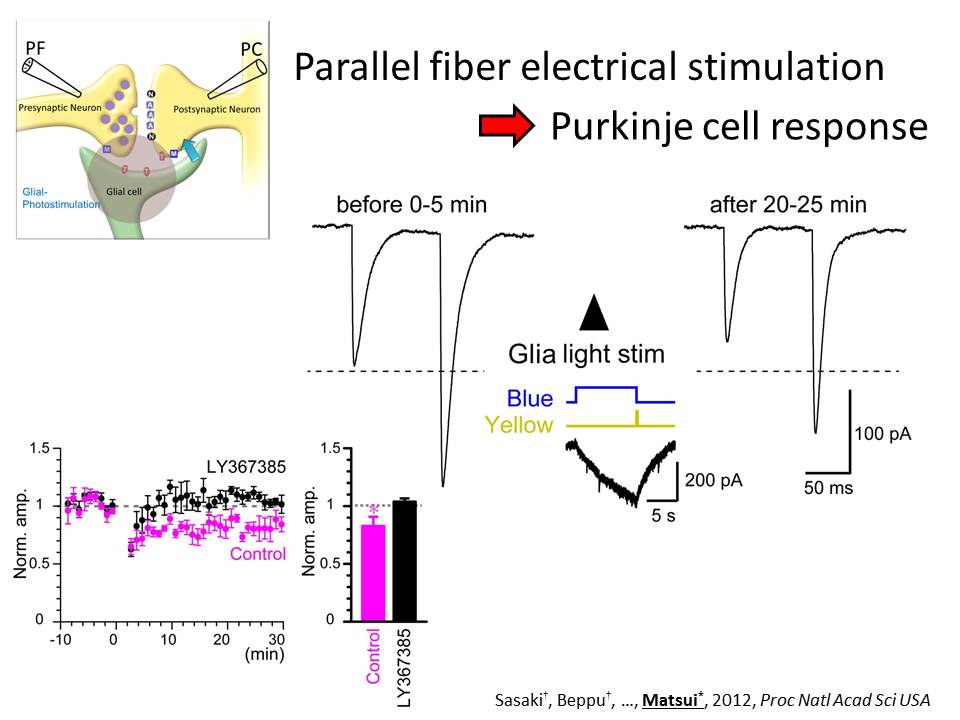
これまでの研究で、小脳のバーグマングリア細胞に電極を刺して、登上線維を刺激すると、登上線維からのグルタミン酸の開口放出に応じて、バーグマングリア細胞の AMPA 受容体が活性化されることが明らかになりました。この応答は、登上線維からシナプス間隙に放出されたグルタミン酸が、シナプス間隙から溢れ出たものを検出しているのか、それとも登上線維からグリア細胞に向けた独立した信号伝達の経路が存在するのかを検証するため、プルキニエ細胞にも電極を刺して、同時記録を行うことにしました。
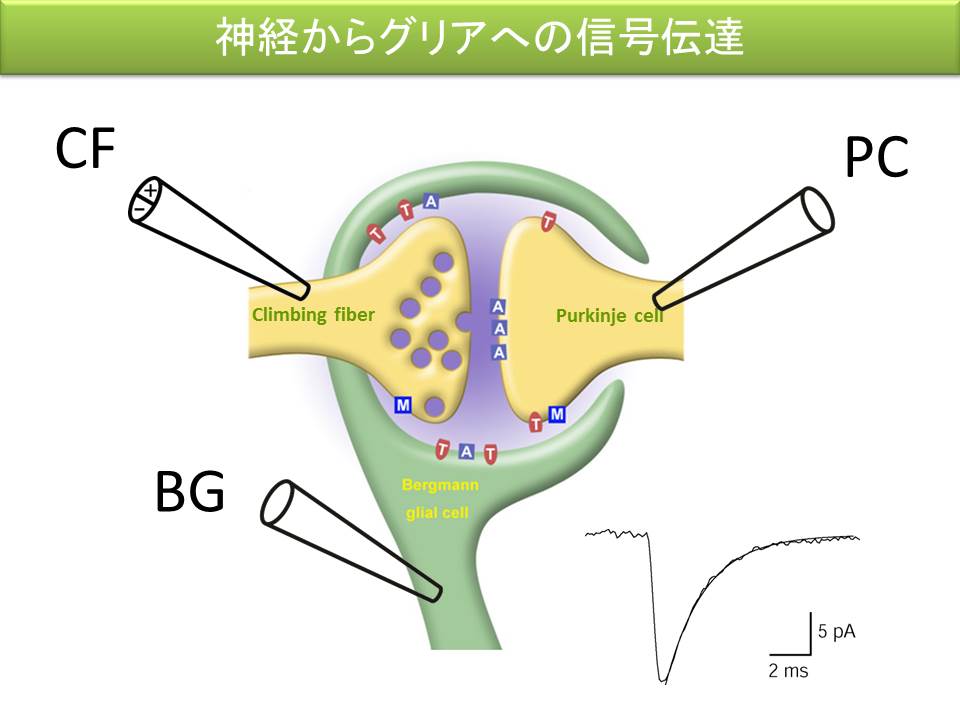
たった一本の登上線維からの入力を共有する、プルキニエ細胞、バーグマングリア細胞の両方から記録し、ひとつひとつのシナプス小胞の開口放出に対する応答、すなわち素量応答を比較してみますと、プルキニエ細胞の素量応答と、バーグマングリア細胞の素量応答が同期していないことが分かりました。このような電気生理学的研究を通して、神経間のシナプス伝達とは別の、独立した異所放出という過程を通して、神経からグリアへの素早い情報伝達が行われていることを、世界で初めて明らかにしました。すなわち、神経からグリアへの信号伝達は、神経間の信号伝達の単なる副産物というわけではないのです。
続いて、このような異所放出が起こる場所は、どこにあるのか。これを検証するため、生きたままの脳組織標本を高解像度で観察できる二光子イメージング法を用いています。下図では、Fluo5F という緑の Ca2+蛍光色素をバーグマングリア細胞に注入し、微細突起のひとつにクローズアップしました。一本のラインからの蛍光を連続的に測定して、時系列順に並べたものが、ラインスキャンになります。矢印の位置で、シナプス前細胞を刺激すると、緑の蛍光が上昇することが分かりました。
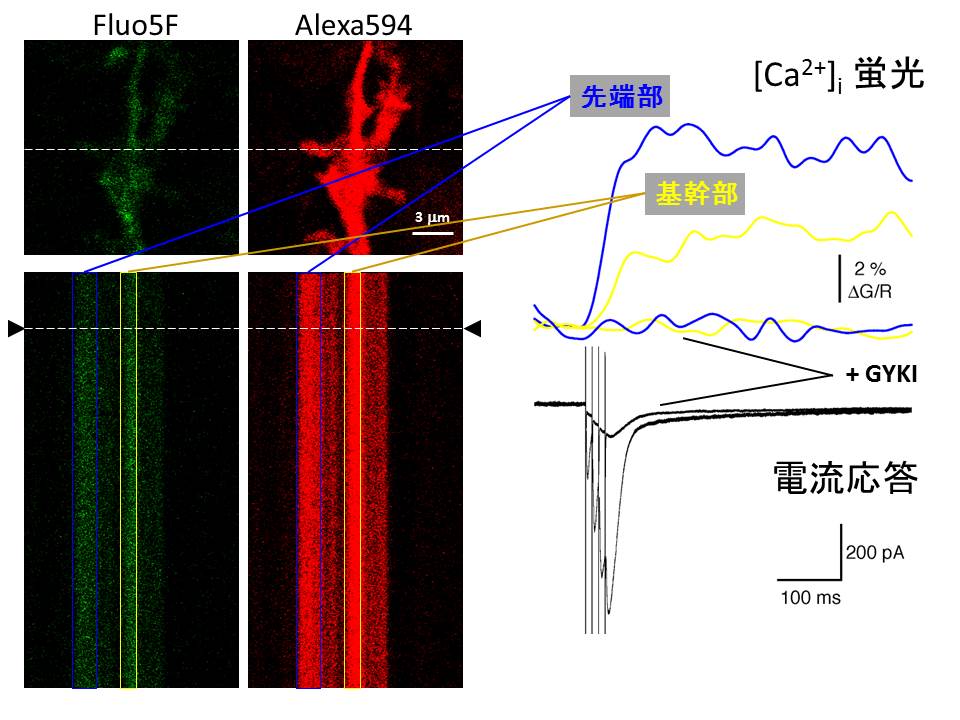
Ca2+濃度に依存した蛍光変化と、グリア細胞にさした電極からの電流記録を並べたものが右に示さています。微細突起の先端部と基幹部の Ca2+蛍光変化を、青と黄色でプロットしました。グリア突起の先端部の Ca2+濃度上昇が、基幹部の Ca2+濃度上昇より高く、素早いことが分かります。AMPA受容体の特異的阻害剤(GYKI)を投与しますと、Ca2+濃度上昇およびシナプス電流応答の大半は消失します。したがって、ここで測定された Ca2+濃度上昇は、グリアの Ca2+透過型 AMPA 受容体を介したものであり、特にグリアの突起の先端部に、集中的に入力があることが分かってきました。
参考文献
-
Matsui K, Jahr CE (2006) Exocytosis unbound.
Current Opinion in Neurobiology, 16: 305–311.
-
Matsui K*, Jahr CE, Rubio ME (2005) High concentration rapid transients of glutamate mediate neural-glial communication via ectopic release.
Journal of Neuroscience, 25: 7538–7547.
(* corresponding author )
-
Matsui K, Jahr CE (2004) Differential control of synaptic and ectopic vesicular release of glutamate.
Journal of Neuroscience, 24: 8932–8939.
(Introduced in "This week in the journal" )
-
Matsui K, Jahr CE (2003) Ectopic release of synaptic vesicles.
Neuron, 40: 1173–1183.
グリアから神経へ
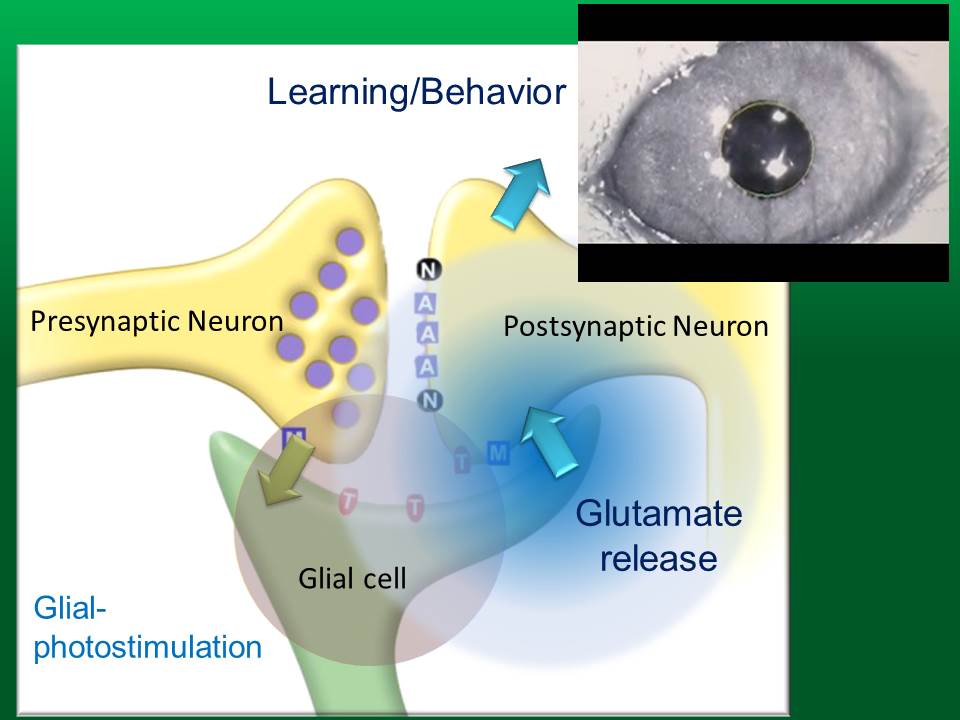
神経から神経へと伝わる信号が、脳における情報処理の全てを担うと考えられてきましたが、例えば異所放出という過程を通して、グリアは神経から信号を受け取ることができ、周囲の神経活動をモニターしていることが明らかになってきました。しかし、いくら信号を受け取っていても、逆に、グリアから神経に信号を送り返す手段がなければ、グリアの活動は、神経の活動に関わり、脳内情報処理に参加することができません。グリアから神経へ、信号を送り返す術はあるのか、あるとすれば、それは神経回路にどのような影響を及ぼすのかを調べたいと考えておりました。しかし、これまで、グリアを特異的に刺激する方法がなかったため、グリアから神経への信号伝達を研究することは困難でした。
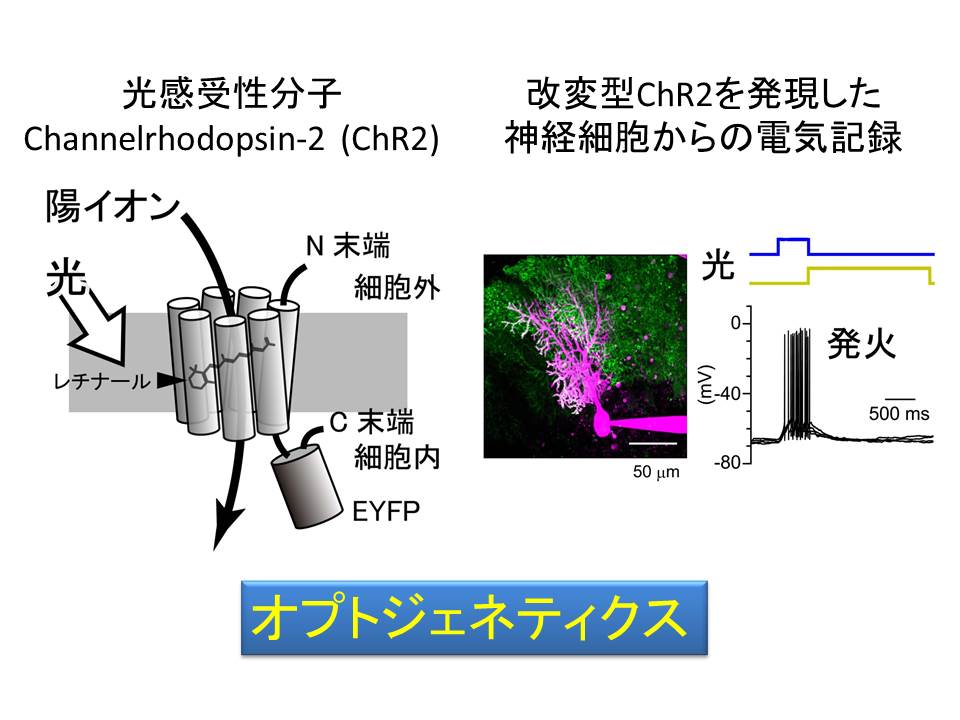
そこで、本来はクラミドモナスという藻に発現する、光感受性分子のチャネルロドプシン2(channelrhodopsin-2; ChR2)をツールとして使うことにしました。この膜タンパク質に光をあてると、陽イオン・チャネルが開き、細胞が興奮することが知られています。例えば、これを神経細胞に人工的に発現させると、細胞の活動が光によって自在に制御できるようになります。
なお、我々は、野生型に比べて、光に対する感度が100倍以上高い改変型(C128S型)ChR2 を使っており、この改変型は、青色の光でチャネルが開き、黄色の光でチャネルが閉じることが知られています。
こういった光感受性分子をツールとした神経科学の研究は、オプトジェネティクス(光遺伝学)と呼ばれ、この数年で世界中の研究室で使われるようになりました。しかし、我々は、これを神経細胞ではなくグリア細胞に発現させるという、これまでほとんど誰も挑戦していない使い道の開発に挑みました。ただ、問題がひとつありました。ひとつひとつのチャネルの働きは弱いので、これをグリア細胞に大量に発現させなければ、細胞活動を自在にコントロールすることができません。
このため、田中謙二先生(現、慶應義塾大学・情動の制御と治療学研究寄附講座・特任准教授)が中心となり、山中章弘先生(現、名古屋大学・神経系分野II・教授)らとともに、細胞種特異的・大量発現の仕組み(KENGE-tet システム)を開発しました。このシステムでは、まず、細胞種特異的なプロモーター下にテトラサイクリントランスアクティベーター tTA を発現するマウスを用意しました。続いて、tTA 存在下で働く tetO プロモーター下で ChR2 を発現するマウスを別に用意しました。この tetO-ChR2 カセットを β-actin サイトにノックインすることで、細胞種によらず、高発現が望めることが明らかになりました。この2種類のマウスをかけあわせることで、ChR2 を細胞種特異的に高発現するマウスが得られました。今回は、これらのうち、グリア細胞のなかのアストロサイト特異的なプロモーター Mlc1 を使った組み合わせに注目しました。
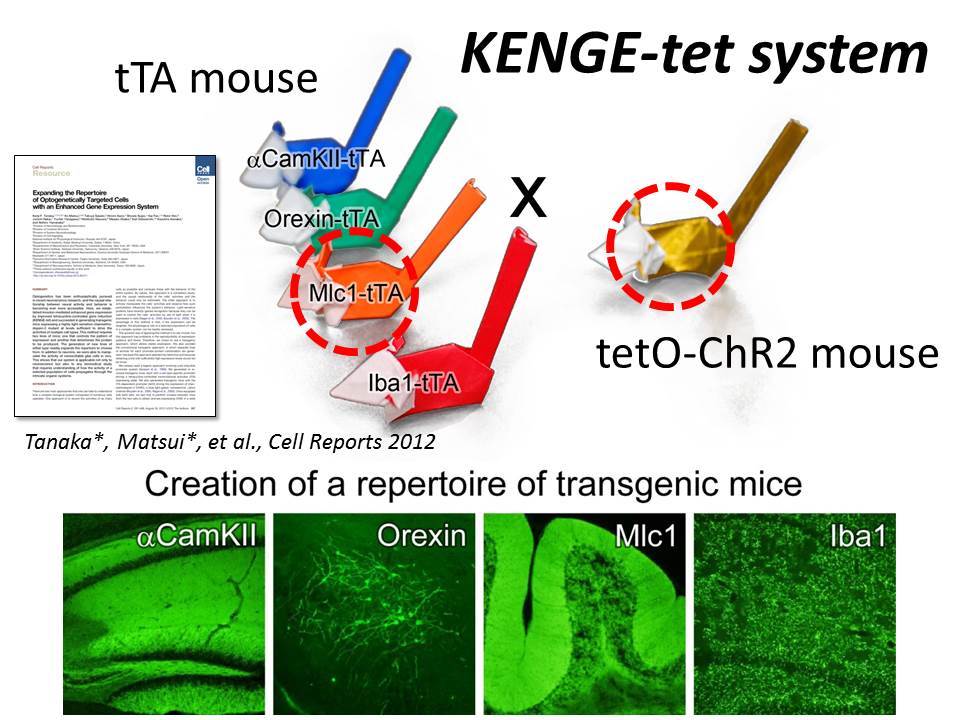
このようにして作製した生きたままの遺伝子改変マウスに、光ファイバーを介して光刺激を行ってみました。光ファイバーは頭蓋骨の上に置いただけで、頭蓋骨には穴を開けていません。頭蓋骨越しの光だけで、十分に ChR2 を活性化させることができることが分かりました。これは、感度の高い改変型ChR2を用いているためです。神経活動に依存して発現が上昇すると言われる c-fos を in situ hybridization を用いて観察しました。影響のあった領域を拡大していくと、神経細胞で c-fos が上昇していることが分かります。矢印の細胞はプルキニエ細胞です。これは驚くべき結果で、グリア細胞を特異的に光刺激したはずなのに、神経細胞の活動が上昇したことを示しています。
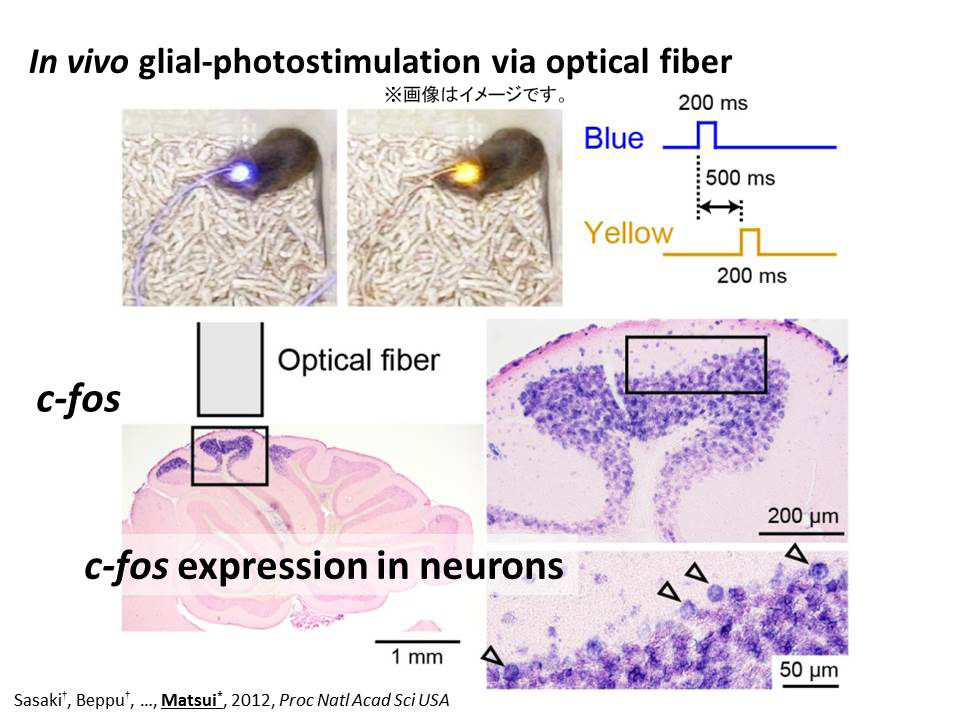
上の実験結果は、グリアから神経へと何らかの形で信号が伝わることを示しています。そこで、グリアから神経への信号伝達を抽出して調べるために、神経からの放出を抑制することにしました。神経が興奮すると Na+および Ca2+チャンネルが開いて、これが神経伝達物質の放出につながります。そこで、どちらのチャンネルも TTX および Cd2+を投与することで阻害しました。この条件下で、グリア光刺激をして、プルキニエ細胞から何らかの応答が記録されたら、それはグリアから放出された伝達物質によるものであると考えられます。
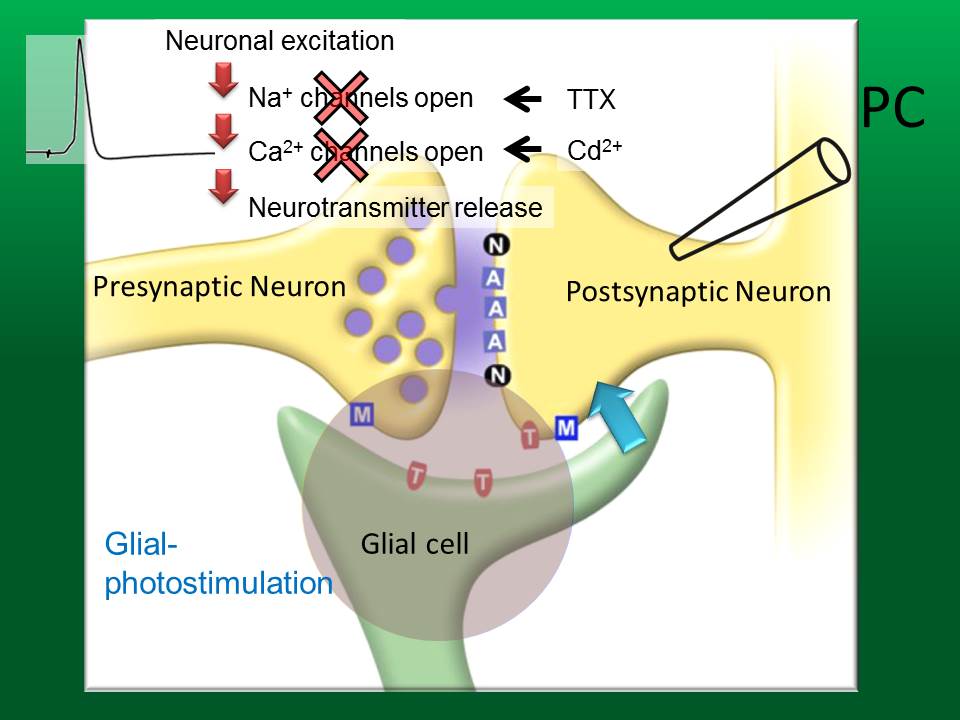
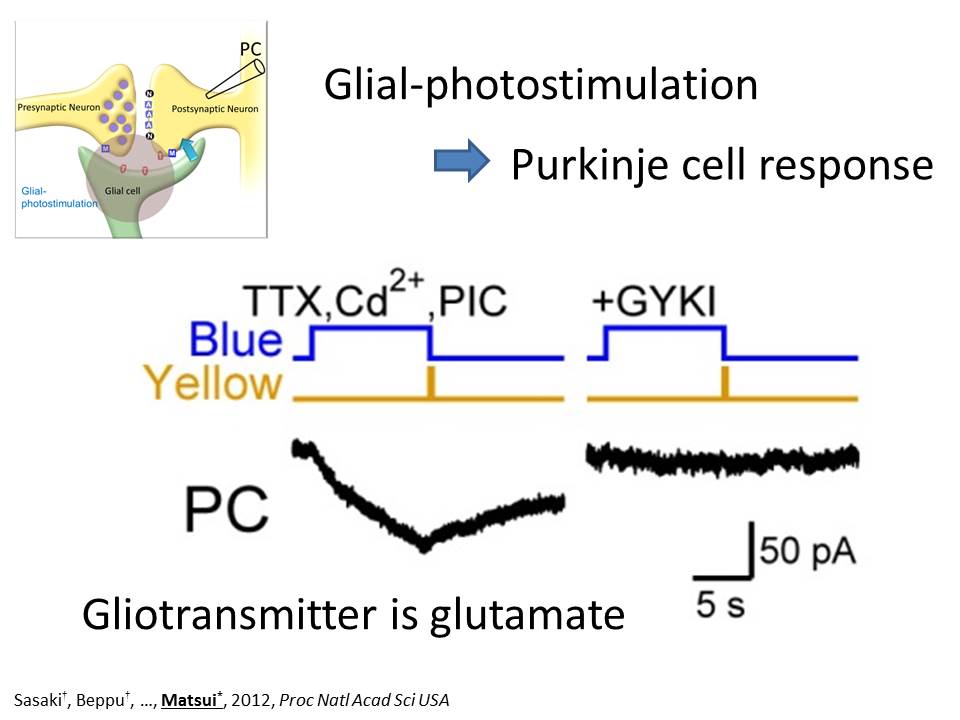
グリアを特異的に光刺激すると、プルキニエ細胞からは、興奮性の内向き電流が記録されました。ここで発現させている ChR2 は C128S 型であるので、青色の光で活性化し、黄色の光で活性が止まります。プルキニエ細胞から記録される内向き電流は、AMPA型グルタミン酸受容体の阻害剤(GYKI)で完全に阻害されました。したがって、グリア細胞から放出されている伝達物質は、グルタミン酸であることが分かりました。これも面白い結果で、興奮性神経細胞が情報伝達に使う伝達物質と全く同じグルタミン酸が、グリアからも放出されていることになります。
グリア光刺激によって、グルタミン酸が放出されることは分かったのですが、このようなグルタミン酸によって、神経間のシナプス伝達がどのような影響を受けるのかを調べました。その結果、グリアからのグルタミン酸放出によって、小脳平行線維-プルキニエ細胞間のシナプス伝達が長期的に抑制されることが分かりました。従来、シナプス可塑性は、神経細胞間の作用だけで生じるものと考えられてきました。この小脳シナプスにおける長期可塑性は、小脳依存性の運動学習に関わることが知られています。我々の研究により、グリアの活動が学習に関わる可能性が出てきたというわけです。
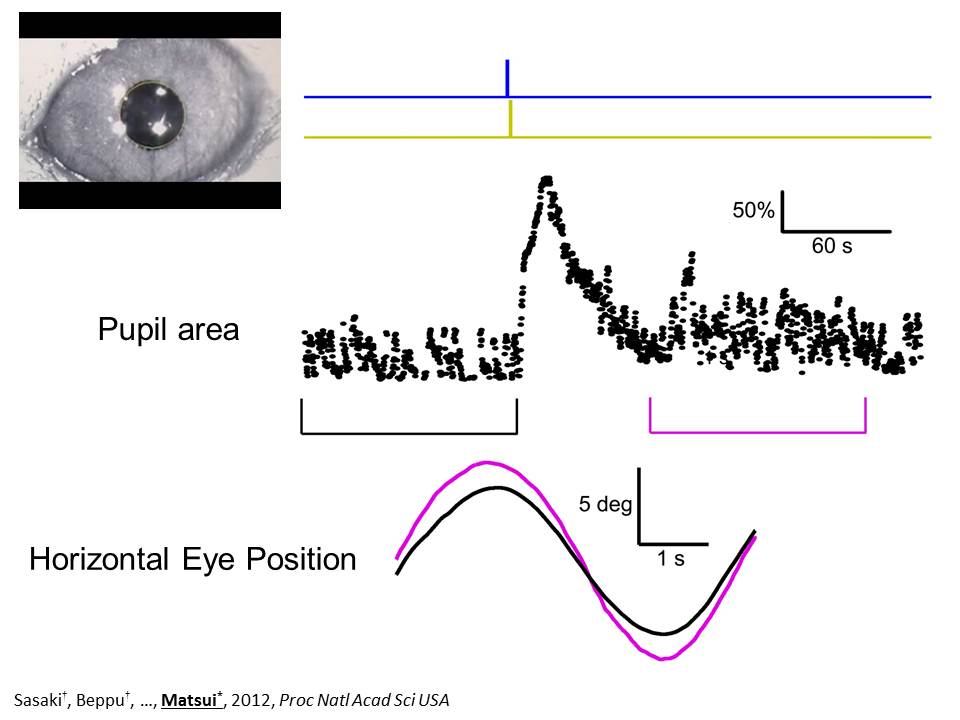
そこで、続いて、生きているマウスのグリア細胞を光刺激し、これがマウスの行動や学習に影響を与えるかどうかを検討することにしました。行動実験で使ったのは水平視機性眼球運動(HOKR)学習パラダイムです。無麻酔のマウスの頭部を固定し、眼球運動を赤外線カメラで計測しました。眼前のチェッカースクリーンを左右にふると、眼球はスクリーンを追って左右に動きます。こういった視覚刺激を何度も繰り返すことで、眼球運動の振幅が数十分単位で増大していき、スクリーンの動きをより忠実に追うようになり、こういった現象を HOKR 学習と呼びます。小脳には光ファイバーを介して、光が送り込めるようにしてあります。

この条件で、HOKR 学習課題中のマウスに光刺激を送り込みました。眼の動きおよび瞳孔サイズが、グリア光刺激によって影響を受けることが分かりました。ちなみに野生型マウスでも同様の光刺激を行いましたが、このような効果は現れず、光ファイバーの側面放射が眼に入った効果というわけではないことが分かります。グリア光刺激によって、主に三つの効果が見られました。はじめは、スクリーンを滑らかに追跡していたのですが、グリア光刺激をした瞬間に追跡が乱れることが分かりました。また、瞳孔のサイズも大きくなることが分かりました。瞳孔の調節は小脳や小脳核を介して行われることが知られており、グリア光刺激によって、これらの回路が駆動されたことを示しています。また、グリア光刺激前の眼球運動の振幅と、刺激後の振幅を比較すると、刺激後に振幅が増大していることが分かりました。つまり、グリア光刺激後に、マウスはスクリーンをより良く追随できるようになったというわけです。言い換えれば、グリア光刺激によって、学習を効果的に加速させることができたことになります。野生型でも同様の実験を行いましたが、この数分の時間では眼球運動の振幅の増大は見られませんでした。
動画が再生できない場合はFirefox等をお試しください。
これまで、グリアが神経活動をモニターしていることは知られていましたが、今回の実験で、光刺激によってグリアの活動を上げると、グルタミン酸が放出されることが分かりました。このグルタミン酸によってシナプス可塑性等が誘導され、究極には、マウスの行動や学習に影響があることが分かりました。脳における情報処理を理解するには、単に神経回路での活動を理解するだけでは足りず、グリア回路の関わりを明らかにする必要があります。グリア回路の関わりを調べるには、このようなオプトジェネティクスは、既に不可欠のツールになっていると考えています。
参考文献
-
松井 広 (2013) 心に占めるグリア細胞の役割-光操作技術のもたらすパラダイム・シフト. 実験医学, 31: 1712-1717.
-
松井 広 (2013) マウスの心の光操作-脳細胞活動と心の機能の因果関係を探る. BRAIN and NERVE, 65: 609-621.
Matsui K (2013) Mind control with optogenetic mice: exploring the causal relationships between brain activity and the mind.
BRAIN and NERVE, 65: 609-621.
-
松井 広 (2013) 脳におけるグリアの役割を光で探る. 「オプトジェネティクス-光工学と遺伝学による行動抑制技術の最前線」(株式会社エヌ・ティーエス): 191–203.
-
松井 広、田中謙二 (2012) 生きたままのマウスの脳細胞を光で操作する技術の開発. OplusE, 34: 1085–1090.
-
Sasaki T†, Beppu K†, Tanaka KF, Fukazawa Y, Shigemoto R, Matsui K* (2012) Application of an optogenetic byway for perturbing neuronal activity via glial photostimulation.
Proc Natl Acad Sci U S A, 109: 20720–20725.
(† equal contribution, * corresponding author )
-
Tanaka KF*, Matsui K*, Sasaki T, Sano H, Sugio S, Fan K, Hen R, Nakai J, Yanagawa Y, Hasuwa H, Okabe M, Deisseroth K, Ikenaka K, Yamanaka A (2012) Expanding the repertoire of optogenetically targeted cells with an enhanced gene expression system.
Cell Reports, 2: 397–406.
(* equal contribution )
病態の理解から脳回路の理解へ
脳は、神経細胞やグリア細胞等の複数の要素が複雑に絡み合った精巧な機械と捉えることができます。要素間の連携がわずかに変化すると、その結果、全体の動作が大きく狂い、様々な病態が生じるのだと考えられます。ただし、壊れた電子回路基板と同じく、病態脳における個々の要素の異常は軽微である場合がほとんどなのではないでしょうか。それなら、細胞間作用をほんの少し人為的に操作すれば、病態脳の治療も可能なのかもしれません。
我々は、特定の細胞種の活動を光で操作するというオプトジェネティクスを用い、病態のメカニズムを理解するとともに、病態の制御を目指します。もちろん、ヒトの脳細胞に予め ChR2 や ArchT などを発現させておくことは困難です。しかし、オプトジェネティクスの研究を通して、病態時に何が起きているのかが明らかになれば、適切な治療ターゲットを提唱することにもつながると考えています。
また、神経とグリアの織り成すネットワーク間の相互作用は、通常の状態では他の作用に埋もれていて、見出すのは困難です。そこで、我々は、脳虚血やてんかんといった極端な環境におかれた脳の研究を通して、グリアの働きを最大限に引き出し、相互作用の存在を明るみに出すことを目指します。神経-グリア・ネットワーク間の相互作用が、いかに脳内回路の恒常性をもたらしていることを明らかにし、病態脳のメカニズムに留まらず、健常脳において、意識等の心の機能がいかに維持されているのかを解明することにも挑戦したいと思っています。

ここで紹介する研究は、2012年1月頃から生理学研究所にて始め、2013年から東北大学大学院医学系研究科に異動してからも実験を継続し、2014年1月になって Neuron 誌に掲載された内容です。公開された時期には東北大学で勤務していましたので、東北大学からのプレスリリースになりましたが、生理学研究所等ならびに東北大学大学院医学系研究科らのグループによる共同研究になります。この研究では、グリア細胞の活動を光で自在に操作するという新技術を用いて、脳におけるグリア細胞の機能、病態時におけるグリア細胞の暴走状態、グリア暴走を止める手段などが明らかになりました。
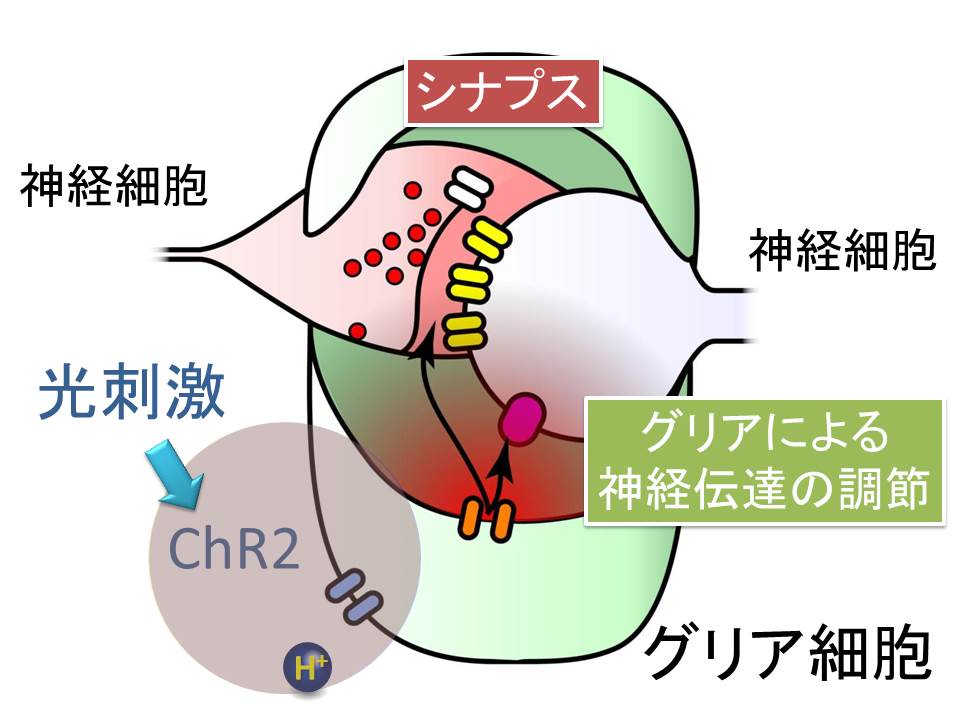
神経細胞から神経細胞への信号伝達に関しては、詳しく調べられてます。信号が伝わる場はシナプスと呼ばれます。神経細胞が興奮すると、細胞外から細胞内へとカルシウムイオンが流れ込んで、これが引き金となって、シナプス小胞という袋に詰められたグルタミン酸が放出されます。これが細胞の受容体に結合することで、次の神経細胞へと信号が伝わるわけです。
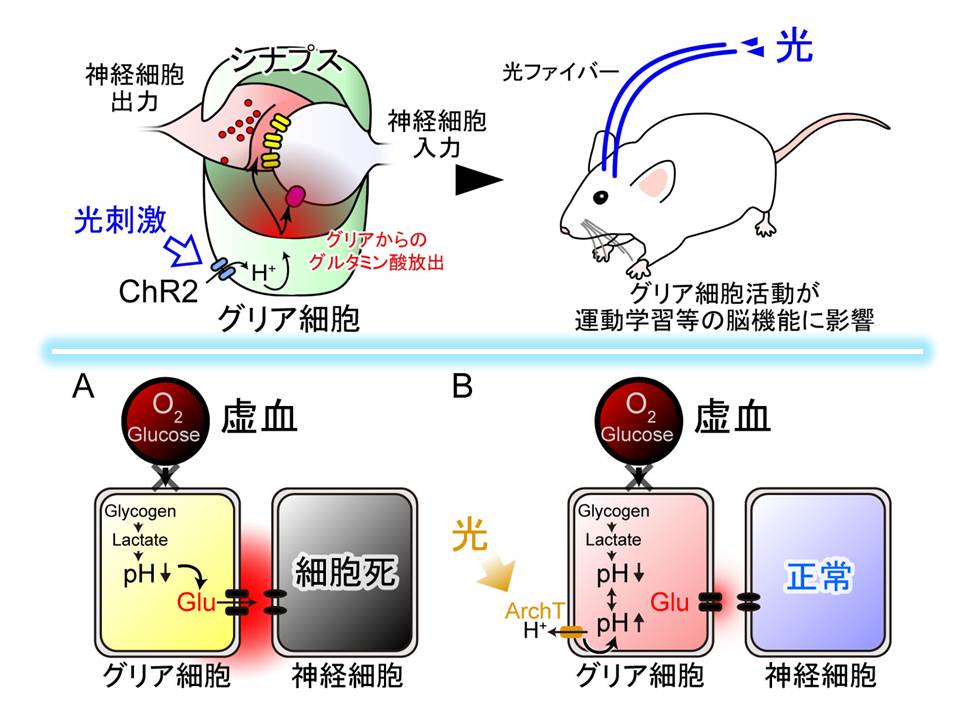
一方、シナプスを取り囲むように配置されているグリア細胞は、どのようにして神経細胞に信号を伝えるのでしょうか。今回、グリア細胞に発現させた光感受性分子のチャネルロドプシン2(ChR2)を光刺激してみました。実験を通じて分かったことは、ChR2 が開くと、細胞内へと水素イオンが流入するということでした。この水素イオンが引き金となって、グリア細胞の陰イオンチャネルを開いて、陰イオンであるグルタミン酸が、細胞内から細胞外へと放出されるということが分かりました。カルシウムイオンではなくて、水素イオンが引き金となっていて、小胞からの放出ではなくて、チャネルを介した放出であること。同じグルタミン酸が放出されるのですが、神経細胞とは全く異なるメカニズムでの放出であることが分かりました。神経細胞からの放出の基本メカニズムが提唱されてから、50年目の新発見になります。
また、このようにして、グリア細胞から放出されたグルタミン酸が神経細胞に作用して、神経伝達の調節などが行われることも明らかになりました。
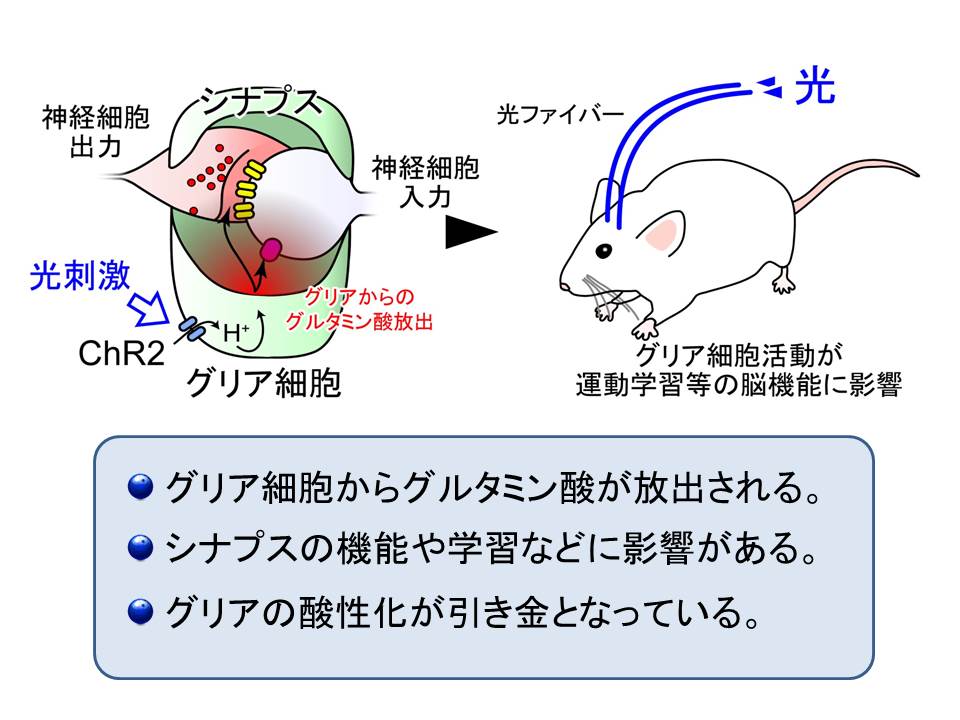
まとめると、グリア細胞からグルタミン酸が放出されること、このグルタミン酸がシナプスの機能や学習などに影響があること、また、グルタミン酸の放出には、グリア細胞内の酸性化が引き金となっていることなどが分かりました。
続いて、グリア細胞の活動が暴走する状態について研究を進めてみました。
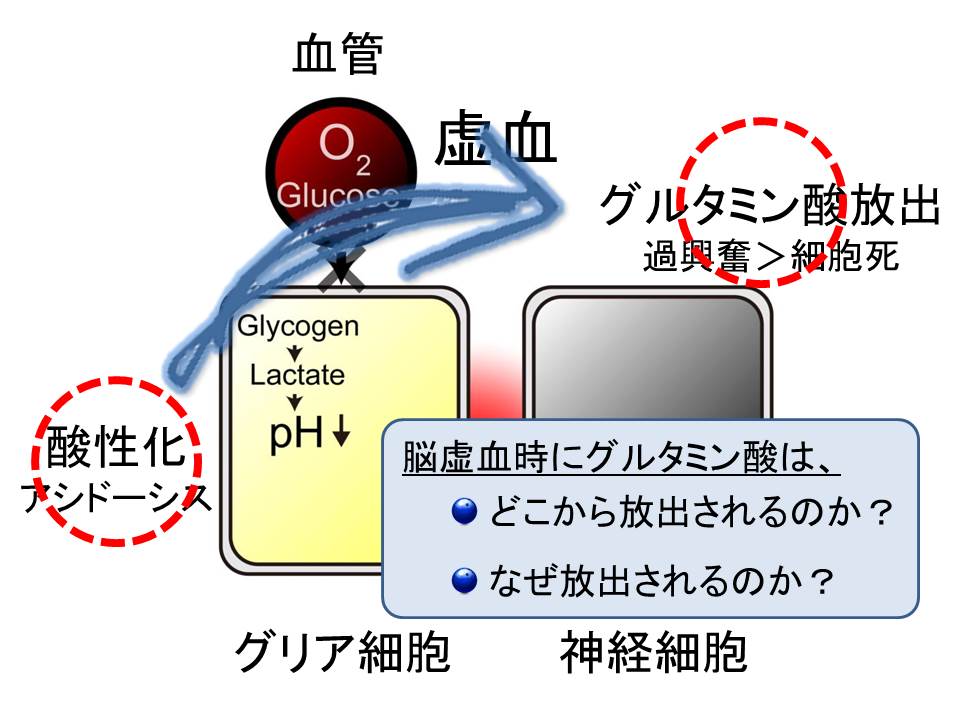
脳梗塞などによって、脳への血流が滞る状態を脳虚血と呼びます。この時、グリア細胞に蓄えられているエネルギー源である、グリコーゲンが分解されて乳酸がたまり、細胞内は酸性化することが知られており、この状態をアシドーシスと呼びます。また、どこからか、グルタミン酸が大量に放出されて、神経細胞は興奮しすぎて、細胞死を起こすことも知られています。
ところがこれまでの研究で、脳虚血時にグルタミン酸は、どこから放出されるのか、また、なぜ放出されるのかが分かっていませんでした。
私は先ほどの ChR2 を使った実験から、酸性化とグルタミン酸放出の間に、因果関係があるのではないかと考えました。
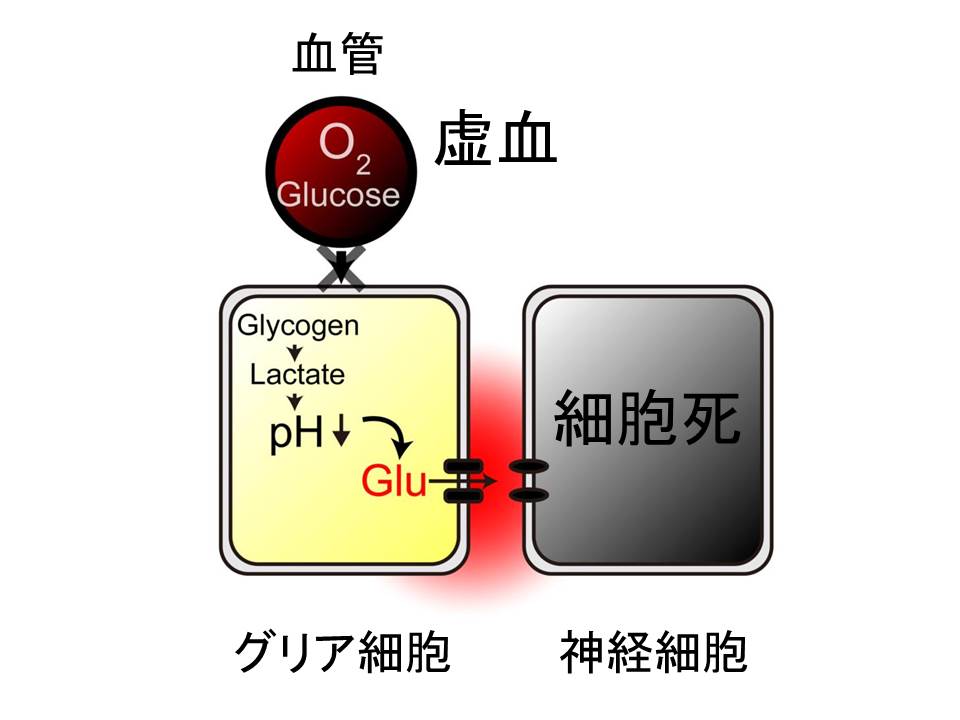
つまり、グリア細胞の酸性化こそが引き金となって、グリア細胞からグルタミン酸が放出されて、過興奮により神経細胞死を招いているのではないでしょうか。
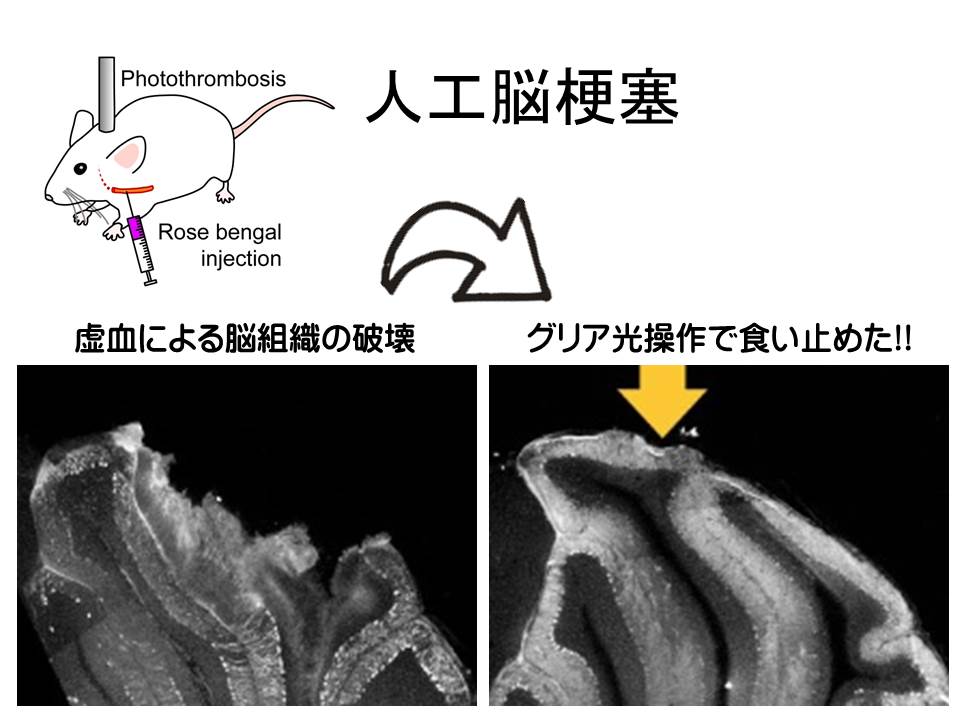
もし、酸性化が原因なら、余分な水素イオンをくみ出してやればいいのではないか。そう考えて、アーキオロドプシン(ArchT)をグリア細胞に発現させてみました。ArchT は、光に反応して細胞内から細胞外へと水素イオンをくみ出す働きがあります。実験の結果、光刺激に伴い、グルタミン酸放出が止まることが明らかになりました。
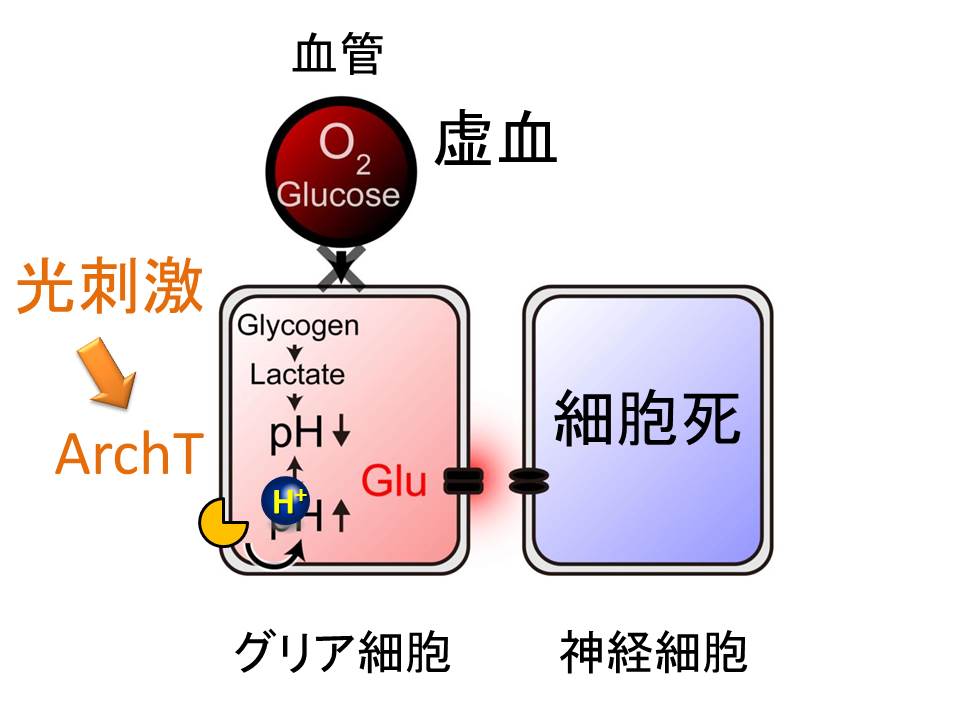
続いて、マウスで実際に人工的な脳梗塞を作る実験をやってみました。脳梗塞ができてから、3時間後には、脳組織がぼろぼろになるほど、脳は破壊されてしまいます。ところが、グリア細胞に発現させた ArchT を光刺激して、グリア細胞をアルカリ化しておけば、脳虚血にともなう脳組織の破壊を食い止めることができました。
つまり、脳虚血時には、グリア細胞の活動が暴走して、グリア細胞からグルタミン酸が大量に放出されることで、脳の破壊が起きているということになります。
以上をまとめますと、グリア細胞からグルタミン酸が放出されるため、グリアの活動は学習等の脳機能に影響を与えることが明らかになりました。これまで、神経細胞だけで担われていると考えられてきた脳や心の働きは、グリア細胞によって調節されている可能性を示唆しています。
また、虚血時のように極端な状況になりますと、グリア細胞の活動は暴走します。グリア細胞内の極端な酸性化によって、大量のグルタミン酸が放出されて、これが脳細胞死を招きます。脳虚血時においても、グリア細胞内の pH を安定させることができれば、グリア細胞の暴走を妨げることができ、神経細胞死の進行を緩和できることが分かりました。これらの発見は、脳梗塞などの新たな治療にもつながるものと期待されます。
参考文献
-
松井 広 (2014) グリア機能の光制御から見えてきた脳科学研究の新しい地平. 細胞工学, 33: 275-280.
-
Beppu K†, Sasaki T†, Tanaka KF, Yamanaka A, Fukazawa Y, Shigemoto R, Matsui K* (2014) Optogenetic countering of glial acidosis suppresses glial glutamate release and ischemic brain damage.
Neuron, 81: 314–320.
(† equal contribution, * corresponding author )













